30nm 染色质左手双螺旋结构模型
4 月 25 日消息,61 年前的今天(1953 年 4 月 25 日),英国剑桥大学卡文迪许实验室的沃森和克里克在英国 Nature 杂志上发表了一篇划时代的论文,向世界宣告他们发现了 DNA 的双螺旋结构,揭开了遗传信息如何传递这个“生命之谜”。这个发现使生命科学的研究深入到分子层次,开启了现代分子生物学时代,成为 20 世纪最伟大的科学发现之一。
人的基因组含有大概 30 亿对碱基,如果把这些碱基对集中到一根 DNA“绳子”上,它的长度大概是 2 米。2 米长的 DNA 要安放在直径只有几个微米的细胞核里,必须以某种方式凝缩起来。在现代生物学的教科书里,这个过程是分四步完成的,这四个过程对应着四个结构:第一级结构是核小体,它是 DNA 双螺旋“绳子”缠绕在组蛋白上而形成的;第二级结构是核小体进一步螺旋化形成 30nm 螺线管,这里 6 个核小体组成一圈形成中空结构的管状螺旋体,即 30nm 染色质纤维;第三级结构是由螺线管再进一步螺旋化成为直径为 0.4 微米的筒状体,也称为超螺旋体;第四级结构就是可以在显微镜下看到的染色体, 它是由超螺旋体进一步折叠盘绕成的。通过以上四步,DNA 的长度被凝缩了 8400 倍左右。以上关于 DNA 的凝缩模型是目前科学界关于 DNA、染色质和染色体组成的基本认识,也是现代生命科学教科书的经典内容。
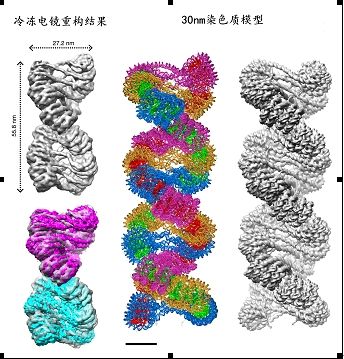
由于缺乏一个系统性的、合适的研究手段和体系,目前对于 30nm 染色质纤维这一超大分子复合体的组装和调控机理的研究还十分有限,对于它的精细结构组成也具有很大争议。近 30 多年来,30nm 染色质纤维高级结构研究一直是现代分子生物学领域面临的最大挑战之一。 2014 年 4 月 25 日(DNA 双螺旋结构发现 61 周年纪念日),国际顶尖研究杂志 Science 上以长幅研究论文(Research Article)形式报道了来自中国科学院生物物理研究所一项关于 30nm 染色质高级结构解析的重大成果。中科院生物物理所长期从事冷冻电镜三维结构研究的朱平研究员和长期从事 30nm 染色质及表观遗传调控研究的李国红研究员通过多年的紧密合作和不懈努力,发挥各自专长和优势,成功建立了一套染色质体外重建和结构分析平台,利用一种冷冻电镜单颗粒三维重构技术在国际上率先解析了 30nm 染色质的高清晰三维结构,在破解“生命信息”的载体 -- 30nm 染色质的高级结构研究中取得了重要突破。该结构揭示了 30nm 染色质纤维以 4 个核小体为结构单元;各单元之间通过相互扭曲折叠形成一个左手双螺旋高级结构(图)。同时,该研究也首次明确了连接组蛋白 H1 在 30nm 染色质纤维形成过程中的重要作用。本研究论文的评审人评论说 “30nm 染色质结构是最基本的分子生物学问题之一,困扰了研究人员 30 余年”,该结果是“目前为止解析的最有挑战性的结构之一”,“在理解染色质如何装配这个问题上迈出了重要的一步”。
高等生物的遗传信息储存在染色体的 DNA 中,每一个体具有 200 多种不同细胞,这些细胞都是从单个受精卵细胞发育分化而来的,具有相同的遗传信息,但是他们的形态和生理功能却大相径庭。研究表明,生命体通过调控细胞核内染色质结构(特别是 30nm 染色质高级结构)的动态变化来有选择性地进行基因的激活和沉默,从而控制细胞自我维持或定向分化,决定细胞的组织特异性和细胞命运,进而形成复杂的组织、器官和个体。因此,研究染色质的高级结构及其调控机制对于理解细胞增殖、发育及分化过程中一些重要基因的表达差异及表观遗传学调控机理具有十分重大的意义。
本研究工作是中科院生物物理研究所朱平研究组、李国红研究组、许瑞明研究组长期合作获得的重要成果,得到了科技部 973 计划,国家自然科学基金委重大研究计划项目和重点项目以及中科院战略性先导科技专项(B类)等的资助。
背景:
1953 年 4 月 25 日,英国剑桥大学卡文迪许实验室的沃森(James Dewey Watson,1928-)和克里克(Francis Harry Compton Crick,1916-2004) 在英国 Nature 杂志上发表了一篇划时代的论文,向世界宣告他们发现了 DNA 的双螺旋结构,从而开启了现代分子生物学时代,成为 20 世纪最伟大的科学发现之一。他们也因为这项开创性的研究与威尔金森分享了 1962 年的诺贝尔生理学或医学奖。
然而,任何有关 DNA 的生命活动(包括基因转录、DNA 复制、修复和重组等)都是在由 DNA 与其所缠绕的组蛋白组装形成的染色质这个结构平台上进行的。近 30 来,染色质的三维结构研究一直是现代分子生物学领域面临的最大的挑战之一。最近,中国科学院生物物理研究所的科学家经过多年的不懈努力,在国际上首次解析了 30nm 染色质纤维的高分辨率冷冻电镜结构,提出了一种全新的染色质纤维的左手双螺旋结构模型,在破译“生命信息”建立和调控的分子机理研究中取得了重大突破。2014 年 4 月 25 日(与 DNA 双螺旋结构的发现同一天),该成果在国际顶尖杂志 Science 上以长幅研究论文(Research Article)报道。
1. DNA 右手双螺旋结构
脱氧核糖核酸(DNA)是全部具有细胞结构的生物遗传信息的载体。这个重要的的分子中储存了生物体用来构建细胞的各种组件的“蓝图”。对于 DNA 的研究可以追溯到 19 世纪。1868 年,瑞士医生米歇尔(Friedrich Miescher, 1844-1895) 以外科手术绷带上的脓中分离出的白细胞为材料,发现了白细胞的细胞核中存在一种能在弱酸性溶液中析出而在弱碱性溶液中溶解的白色丝状物质,他把它命名为“核素(nuclein)”。这就是后来被人们所熟知的 DNA。他还通过燃烧实验证明核素中存在大量的有机磷元素。此外,他还发现很多其他的细胞组织中,如肾细胞、肝细胞中也都可以提取到这种物质。因为这种物质是从细胞核中提取的,而且具有酸性,因此人们又称它为“核酸” 。
对于核酸组分和结构的研究到了二十世纪才取得比较大的进展。德国生化学家柯塞尔(Albrecht Kossel,1853-1927) 的研究搞清楚了核酸是由五种不同的碱基(腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)、胞嘧啶(C)和尿嘧啶(U))及核糖、磷酸组成。柯塞尔因对细胞核化学组分的研究获得了 1910 年的诺贝尔生理学医学奖。1929 年,俄裔生化学家利文(Phoebus Levene,1869-1940) 又确定了核酸其实有两种,一种是脱氧核糖核酸(DNA),另一种是核糖核酸(RNA)。到了 1944 年,埃弗雷、麦克利奥特及麦克卡蒂(Oswald T. Avery, Colin MacLeod 与 Maclyn McCarty)通过肺炎双球菌的体外转化实验终于证明了 DNA,而非蛋白质,才是遗传信息的物质载体。接下来,研究界的目光立刻投向了对 DNA 结构的研究。
1951 年,奥地利生化学家查戈夫(Erwin Chargaff,1905-2002) 提出了著名的“查戈夫规则”,即几乎所有类型的 DNA,不管是来自哪种生物或组织细胞, 其中的腺嘌呤与胸腺嘧啶数量几乎完全一样,鸟嘌呤与胞嘧啶的数量也是一样。这个规则的提出也为揭示 DNA 的结构铺平了道路。1953 年 4 月 25 日,受到了富兰克林 (Rosalind Elsie Franklin,1920-1958) DNA 晶体X-射线衍射照片的启发,英国剑桥大学卡文迪许实验室的沃森(James Dewey Watson,1928-)和克里克(Francis Harry Compton Crick,1916-2004) 在英国《Nature》杂志上发表了一篇划时代的论文,向世界宣告他们发现了 DNA 的双螺旋结构。接着他们又在 5 月 30 日出版的《Nature》杂志上发表了一篇题为“DNA 的遗传学意义”的文章。他们也因为这项开创性的研究与威尔金森分享了 1962 年的诺贝尔生理学或医学奖。
DNA 双螺旋模型显示 DNA 中四种碱基排列在双螺旋的内部,并以A-T、C-G 的方式配对;脱氧核糖和磷酸基团排列在外部,通过磷酸二酯键交替连接起来。两条主链以麻花状绕同一螺旋轴以右手方向盘旋形成方向相反的双螺旋。由于两条主链上配对的碱基并不在一个平面上而是有一定的交角,因此在双螺旋表面形成了由大沟和小沟组成的两种凹陷。DNA 双螺旋的直径 2 nm,沿螺旋轴上升一圈有 10 对碱基;螺距为 3.4 nm,相邻碱基对平面的间距为 0.34 nm。双螺旋结构显示出 DNA 分子在细胞分裂时能够以自我复制的方式将核苷酸序列中的信息完整的传递给子代分子,解释了生物体要繁衍后代,物种要保持稳定,细胞内必须具有维持遗传稳定性的机制。DNA 双螺旋结构也为人们提供了对 DNA 分子进行人工操作的结构基础。自此,生命科学进入了分子生物学时代,在其后的几十年中,以基因工程为代表的一系列分子生物学技术极大地改变了我们的日常生活。
2. 我们人类的基因组
A. 我们每个人的基因组 DNA 大概有多长?
我们人类是二倍体生物,正常体细胞中含有两套染色体组,一套来自于父方,一套来自于母方。我们每个个体的生命都是从一个精子和一个卵子相结合开始的。精子和卵子都是单倍体细胞,只含有体细胞中的一套染色体组。精子与卵子结合形成受精卵,成为二倍体细胞,含有两套分别来自父母的完整染色体组。受精卵经过发育分化,形成万亿个各种功能各异的细胞;这些亿万个组织特异性的细胞有机地结合成为各种器官系统和不同组织,最后便形成一个婴儿!对于人类的单倍体细胞(如精子或卵子),DNA 分子组装成 23 条染色体,一共含有 30 亿个碱基对(3×109 个)。由于人类的体细胞是二倍体,这就意味着每个体细胞中含有 46 条染色体,其 DNA 量是由多达 60 亿个碱基对组成 [即 2 ×(3×109)= 6×109 个] 。每个碱基对的长度大约有 0.34 纳米(1 纳米=10-9 米)。如此推算,那么每个二倍体细胞中就应该有约 2 米长的 DNA [(0.34×10-9)×(6×109)≈2 米 ]。也就是说,我们身体中,一个体细胞的 DNA 长度加起来约有 2 米。
据估算我们每个人体内大约含有 50 万亿个细胞(即 50×1012), 那么体内含有 DNA 总长应该为 100 万亿米长[(50×1012)×2 =100×1012 米]。太阳距地球大概 1500 亿米(1.5 亿公里),一个来回就是 3000 亿米(3 亿公里)。将人体 DNA 分子连接起来,其长度相当于地球到太阳来回距离的 300 倍,[(100×1012)÷(300×109)=330≈300]。
B。我们的人体和细胞怎么容下这么长的基因组 DNA?
我们上面介绍了人体细胞中的 DNA 长度:每个二倍体细胞中的 DNA 加起来有 2 米长。如果粗略的按 46 条染色体测算,每条染色体包含的 DNA 长度平均是 4 厘米左右。(需要说明的是,不同染色体大小是有差异的;这里仅作粗略测算,是为给大家一个形象的说明,以方便理解)。
接下来,一个重要的问题是,这么长的基因组 DNA 到底包藏躲在人体或细胞的什么地方?有趣的是,科学家们发现我们的 DNA 主要被包装在细胞核内中的染色质里。另外,构成我们人体的细胞,形态大小各异,大的细胞如卵子直径可以达到 130 微米左右,小一些的细胞直径只有5~6 微米。而那么我们的 2 米长的基因组 DNA 分子又是怎样组装、紧密压缩到 10-20 微米的细胞核空间内的呢?细胞中有一类性质特异的蛋白质,组蛋白八聚体,能够组装基因组 DNA 形成染色质,并进一步折叠凝聚形成非常复杂的染色质三维结构,把基因组 DNA 压缩到真核生物的细胞核内。
2. 染色质的三维结构
在真核细胞中,DNA 总是以染色质的形式存在,每一个细胞都有约 2 米长的 DNA 链通过染色质紧密折叠被包含在几个微米的细胞核里。染色质早在 1879 年就被德国生物学家弗莱明 Flemming 提出,用于描述细胞核中已被碱性染料染色的物质。其在细胞有丝分裂期高度折叠形成染色体。
染色质是遗传物质基因的主要载体,是调节生物体新陈代谢、遗传和变异的物质基础。所有有关 DNA 的生命活动都是在染色质这个结构基础上进行的:染色质使基因组 DNA 有序组织在有限大小的细胞核内;同时保证细胞分裂过程中 DNA 的有序分离;保护 DNA 以有效防止 DNA 损伤;并控制基因的转录活性。
虽然染色质的概念早在 1879 年就被提出,但是直到一百年后的 1974 年,Kornberg 利用生物化学和电镜成像技术,才发现染色质的一级结构,即由 DNA 串联的 11nm 核小体串珠结构。核小体是染色质结构的基本单元,由 147bpDNA 缠绕组蛋白八聚体(由四种组蛋白 H2A、H2B、H3 和 H4 各两个分子组成的扁球状八聚体)1.75 圈组成,其高精度精细结构于 1997 年被 Richmond 研究组解析。染色质一级结构折叠形成染色质二级结构“30nm 染色质纤维”。教科书上认为 30nm 染色质纤维是染色质一级结构经螺旋化形成每一周包含 6 个核小体的螺旋管线状体。但是由于 30nm 染色质纤维的精细结构一直没有被解析,其结构模型目前仍然存在着很大的争议。染色质二级结构再进一步折叠形成更为复杂的染色质高级结构,从而实现将长达 2 米的基因序列有规律的归集在微米级的细胞核中。
除了细胞核中染色质的整体组织形式受到细胞周期调控以外,其局部结构也是高度动态的,受各种表观遗传因素的调控,包括组蛋白变体,DNA 和组蛋白化学修饰等。染色质结构的动态调控与其相关基因的活性密切相关:染色质结构紧密,阻碍 DNA 与各种转录因子或 DNA 修复因子的作用,从而抑制基因活性;另一方面,染色质结构松散暴露 DNA,使得基因活性被激活。
3. 染色质左手双螺旋结构的确立
长期以来,对多个核小体以何种方式装配形成 30nm 染色质高级结构,以及该结构受什么因素调控一直是研究者梦寐以求,对生命信息的传承和调控至关重要的信息。正如本研究论文评审人指出的:“30nm 染色质结构是最基本的分子生物学问题之一,困扰了研究人员 30 余年”。这个问题的困难性主要来源于两个方面:第一,细胞核内的染色质结构高度变化,受多种因素的影响,难以获得适合高分辨率结构研究、具有高度均一性的染色质样品;第二,30nm 染色质是一个典型的超大分子复合体,对这种超大分子复合体的高分辨率研究缺乏一个系统性的、合适的研究手段和体系,具有极大的技术难度和挑战性。因此,目前对于 30nm 染色质纤维这一超分子复合体的组装和调控机理的研究还十分有限,对于 30nm 染色质纤维的精细结构及其结构模型的理解都还十分不确定并具有很大争议。对于第一个方面的困难,研究者通过多年的努力,发现利用体外表达一种具有特殊性质的 601DNA 和组蛋白八聚体,可以获得适合高分辨率研究的核小体和染色质;同时,通过改变不同的组蛋白修饰、组蛋白变体、不同的连接 DNA 长度等多种条件可以对各种影响染色质结构及动态变化的复杂因素在体外进行相关研究;对于第二方面的困难,近年来在结构生物学领域蓬勃发展,并在近原子分辨率三维结构重构方面取得重要性突破的一种冷冻电镜三维重构方法为研究 30nm 染色质的高级结构提供了一个最为合适的工具。
中国科学院生物物理研究所长期从事冷冻电镜高分辨率三维结构研究的朱平研究员和长期从事 30nm 染色质及表观遗传调控研究的李国红研究员发挥各自特长,对这一难题进行了紧密合作和长期攻关。李国红研究组依据多年在 30nm 染色质和表观遗传学研究方面的长期积累,成功建立了一套染色质体外重建和结构分析平台,获得了适合高分辨率研究的高度均一 30nm 染色质样品;朱平研究组依靠在冷冻电镜高分辨率结构解析方面的长期积累,利用冷冻电镜单颗粒三维重构方法获得了由 12 个和 24 个核小体组成的 30nm 染色质纤维的高分辨率三维重构结果。这是两个研究组紧密合作,在世界上首次解析的染色质清晰高级结构图。他们解析的结构揭示了 30nm 染色质纤维以 4 个核小体为结构单元相互扭曲形成;结构单元的形成和单元之间的扭转由不同方式的作用力介导;四聚核小体结构单元之间的空隙可能是组蛋白修饰、染色质重塑等重要表观遗传现象发生的调控控制区域。同时,他们的研究发现连接组蛋白 H1 在单个核小体内部及核小体单元之间的不对称分布及相互作用促成 30nm 高级结构的形成,首次明确了连接组蛋白 H1 在 30nm 染色质纤维形成过程中的重要作用。同时,和长期从事X射线晶体学研究的结构生物学家许瑞明研究员研究组合作,他们发现各个四聚核小体单元之间通过相互扭曲折叠成为一个和 DNA 右手双螺旋类似的左手双螺旋染色质纤维高级结构(图)。这些研究结果对于 30nm 染色质纤维高分辨率结构精细模型建立这一重大科学难题的破解,以及对于染色质的高级结构组装的分析及表观遗传调控机制的研究是一个重要的突破性进展,并为预测体内染色质结构建立的分子基础以及各种表观遗传因素包括组蛋白变体、组蛋白化学修饰等对染色质结构调控的可能机理提供了可靠的结构基础。
4. 染色质双螺旋结构发现的科学意义
高等生物的遗传信息储存在染色体的 DNA 中,每一个体具有 200 多种不同细胞,这些细胞都是从单个受精卵细胞发育分化而来的,具有相同的遗传信息,但是每种细胞的表型和功能都不一样。一个重要生物学问题就是具有相同基因组的同一个体中不同功能的各种细胞的命运是如何决定的。虽然十年前科学家就获得了人类基因组序列的线性图谱,但是某些问题我们仍未解开——除了众所周之的 DNA 双螺旋结构,基因组是如何准确折叠的呢?基因组折叠的方式决定了哪些基因开启,哪些基因关闭,因此研究基因组三维结构可以解释基因组如何运作。最近研究表明细胞命运的决定主要是通过表观遗传机制有选择地进行基因沉默和基因激活来实现的,从而控制细胞自我维持或定向分化,决定细胞的组织特异性和细胞命运,从而形成复杂的组织、器官和生命体。另外,大量研究表明表观遗传调控机制是生命现象中的一种普遍存在的调控方式,涉及生命现象的方方面面,在干细胞维持和自我更新与分化,个体的衰老和发育异常,如肿瘤、糖尿病、精神病及神经系统疾病等复杂疾病的发生发展中起着决定性的作用。
表观遗传及其调控机制是当今生命科学的一个重要的前沿和热点领域。表观遗传信息被建立后,通常认为并不直接影响转录,而是通过影响染色质高级结构或者在效应蛋白的帮助下影响染色质高级结构的动态变化,来实现对基因表达的调控从而实现对基因表达的调控。然而表观遗传信息怎样影响染色质的高级结构则长期以来所知甚少,以至于在众多文献中研究者们常常把不能解释的一些事件归咎为“该因子以某种方式改变了染色质的高级结构”。而染色质的高级结构变化也成了科学界的一个“黑箱”。染色质的高级结构的第一级形态是染色质的 30 纳米纤维。在教科书中,30 纳米纤维被描述为“螺线管 (solenoid)”,但该结构从未被正式以结构生物学手段得到解析,是染色质和表观遗传学领域长期以来的高难度科学问题。由于 30 纳米染色质纤维本身的结构都未被解析,表观遗传信息对其结构乃至更高级染色质结构的影响更是无从谈起。
30nm 染色质纤维是由核小体-核小体有序堆积而成。近 30 年来,30nm 染色质纤维结构受到广泛的关注,大量的生物化学和生物物理学技术,如电镜、小角度X-ray 散射、中子散射、圆二色谱等被用来研究 30nm 染色质纤维的结构。鉴于染色质结构的复杂性和研究手段的局限性,目前在染色质的高级结构及调控领域缺乏一个系统性的、合适的研究手段和体系,对于 30nm 染色质纤维这一超分子复合体的组装、精细结构和调控机理的都不是十分清楚。虽然核小体自身的高分辨晶体结构已被解析,但是目前对于 30nm 染色质纤维的认识还是相当有限,特别是对 30nm 染色质纤维精细结构的解析、30nm 染色质纤维的组装和调控机理、及其结构动态变化在基因转录调控中的作用机理的研究还处于起步阶段。因此,30nm 染色质纤维的三维结构研究一直是现代分子生物学领域面临的最大的挑战之一。
中国科学院生物物理研究所充分发挥多学科交叉的传统优势,紧紧围绕蛋白质科学领域的基础性、前沿性重大科学问题开展持续深入研究。面向 2020 年,生物物理研究所明确提出“一个定位、三个重大突破、五个重点培育”的重点发展规划,将“真核膜蛋白和蛋白质复合体结构与功能关系”列为三个重大突破方向之一。设立了“染色质结构和细胞命运决定的机理研究”一三五目标导向团队,组织在染色质功能、表观遗传调控、高分辨率冷冻电镜三维重构、X-射线晶体学等研究领域的研究队伍,增加稳定支持,促进团队成员之间的分工协作。在中国科学院战略性先导科技专项(B类)“生物超大分子复合体的结构、功能与调控”的重点支持下,在中科院蛋白质科学平台(已整体纳入国家蛋白质科学北京设施)的全面支撑下,对 30nm 染色质高级结构这一重大科学难题展开联合攻关。首次利用冷冻电镜单颗粒三维成像技术解析了由 12 个核小体和 24 个核小体组成的 30 纳米染色质纤维的高级精细结构。这是分子生物学领域内国际领先的突破性前沿成果,为解析人类重要疾病(如肿瘤和衰老)发生和发展的分子机理,探讨重要疾病的治疗及药物研发提供重要的理论指导。
通过以上研究,我们在国际上率先打通了 30 纳米染色质结构解析的道路,这为该研究团队继续研究表观遗传信息对 30 纳米染色质结构的影响提供了得天独厚的竞争优势。这一重大突破使得我们研究团队有望成功回答染色质修饰(包括 DNA 甲基化和组蛋白修饰)、染色质变体组成等一系列表观遗传信息对 30 纳米染色质纤维的结构影响,这些工作将对学科的发展起到重要的引领作用,从而使我国在染色质三维结构这个领域处于国际领先地位。同时,研究染色质三维结构及其调控机制对于理解细胞增殖、发育及分化过程中一些重要基因的表达差异及表观遗传学调控机理具有十分重大的意义,对提升我国在干细胞和表观遗传学等领域的研究水平也有促进作用。
5. 中国科学院蛋白质科学研究
中国科学院蛋白质科学研究历史悠久、实力雄厚,1965 年上海生化所等首次人工全合成了蛋白质——结晶牛胰岛素,1972 年生物物理所等解析了国内第一个生物大分子——胰岛素的高分辨率晶体结构。近年来,菠菜主要捕光复合体的晶体结构解析实现了我国膜蛋白结构解析零的突破,线粒体膜蛋白复合体Ⅱ的三维结构研究则填补了我国线粒体结构生物学和细胞生物学领域的空白,上述成果均为领域内公认的里程碑量级的原创性工作。
长期以来,我院已形成一支在国内外有影响力的蛋白质科学研究队伍,其中两院院士 11 人、千人计划 8 人、杰出青年 15 人、青年千人计划 8 人、百人计划 40 人,优秀研究员队伍 100 多人。以两院院士牵头、千人计划领军,杰出青年、青年千人计划、百人计划为骨干的极具创新活力的研究团队是我院蛋白质科学研究的坚实基础。
在重大设施建设方面,国家高瞻远瞩地批准了国家蛋白质科学研究设施建设项目,中科院的上海生科院、生物物理所是建设主力。2008 年 11 月 14 日,国家发展和改革委员会批准国家重大科技基础设施项目——国家蛋白质科学研究设施的项目建议。在此项批复中明确了国家蛋白质科学研究设施的主要建设任务为:(一)由军事医学科学院作为项目法人单位,清华大学、北京大学、生物物理所为共建单位,在北京市建设以蛋白质组学研究能力为主的蛋白质科学研究设施。(二)由中国科学院上海生命科学研究院作为项目法人,在上海市建设以蛋白质结构解析能力为主的蛋白质科学研究设施。在此基础上中科院院已批准成立“中国科学院蛋白质科学中心”,中心下设“中国科学院蛋白质科学中心(北京)”和“中国科学院蛋白质科学中心(上海)”。北京中心依托生物物理所现有的蛋白质科学平台和国家蛋白质北京设施(生物物理所部分),上海中心依托国家蛋白质上海设施及上海光源两个重大科学设施。两个中心有效联合,相互补充,南北呼应,在中科院统一领导下,通过一体化协同运行,构成了中科院蛋白质科学研究的整体布局。
生物物理研究所中长期规划中将“真核膜蛋白和蛋白质复合体结构与功能关系”、“建立认知基本单元的理论框架”、“生物成像瓶颈技术突破”等列为三个重大突破方向,将“疾病发生与干预的蛋白质结构基础”、“认知的分子神经基础及认知障碍”、“抗病毒新靶点与防治新策略”、“非编码 RNA 的系统发现与功能结构”、“新型抗肿瘤生物技术药物”等列为五个重点培育方向。生物物理所的蛋白质科学研究主要分为三个方向:结构生物学、生物膜与膜蛋白,蛋白质合成与调控,凝练出重点发展方向,围绕膜蛋白结构和功能,染色质结构、表观遗传调控与细胞命运决定,细胞内膜系统形成及其稳态维持的调控机制,疾病发生与防御的蛋白质结构和功能基础,蛋白质的生成、修饰与质量控制等五个方向开展研究。
6. 中国科学院战略性先导科技专项
中国科学院战略性先导专项包括前瞻战略科技专项(A类先导专项)和基础与交叉前沿方向布局(B类先导专项)两类。A类先导专项侧重于突破战略高技术、重大公益性关键核心科技问题,促进技术变革和新兴产业的形成发展,服务我国经济社会可持续发展。B类先导专项侧重于瞄准新科技革命可能发生的方向和发展迅速的新兴、交叉、前沿方向,取得世界领先水平的原创性成果,占据未来科学技术制高点,并形成集群优势。
B 类先导专项由前沿科学与教育局负责策划、组织实施和管理。目前B类先导专项已启动实施 10 项,拟启动实施 5 项,十二五期间计划共启动 20 项。“生物超大分子复合体的结构、功能与调控”先导专项于 2014 年 3 月 17 日正式启动实施,专项共有 3 个项目,9 个课题,26 个子课题,共 33 名核心成员。专项依托单位为生物物理所,专项承担单位共 8 个,分别为生物物理所、上海生科院、中科大、微生物所、上海药物所、高能物理所、遗传发育所、应用物理所。专项首席科学家为饶子和院士。超大分子复合体先导专项瞄准“生物超大分子复合体的组装调控与细胞生命过程关系”这一关键科学问题,以期在原子水平上重现细胞中的动态生命过程,力争攻克若干超大分子复合体的世界性难题,产生里程碑式的重大科学成就。同时,瞄准关键技术瓶颈突破,建立超大分子复合体高分辨率结构和动态构象研究的技术体系,为重大原创性工作的产出提供技术支撑。