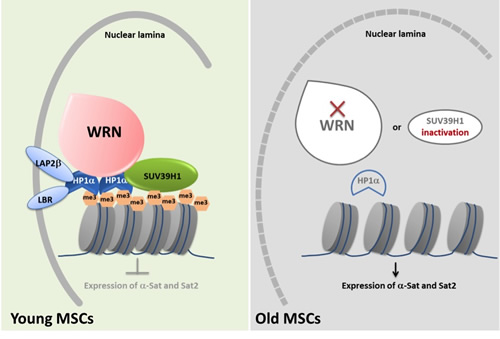
描述 WRN 保护异染色质稳定性的示意图
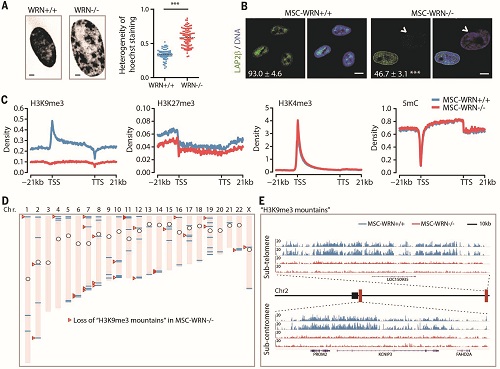
表观遗传组学分析显示,早衰症干细胞的异染色质发生了显著的结构退行性变化,主要表现为着丝粒和端粒附近的 H3K9me3“山脉”(mountains)的缺失。
2015 年 4 月 30 日,Science杂志在线发表了北京大学生命科学学院生物动态光学成像中心汤富酬实验室、中科院生物物理所刘光慧实验室、以及 Salk 研究所 Juan Carlos Izpisua Belmonte 实验室在干细胞衰老机理方面的一项突破性的研究成果。该研究结合多能干细胞定向分化技术、基因组靶向编辑技术、以及表观遗传组分析技术首次揭示了异染色质的高级结构失序(disorganization)是人类干细胞衰老的驱动力之一,为延缓衰老及研究和防治衰老相关疾病提供了新的潜在靶点和思路。
目前世界各国均面临着严重的人口老龄化,2050 年约三分之一的中国人口年龄将超过 60 岁。衰老是人类疾病最大的危险因子,针对衰老的基础和转化医学研究正成为全人类共同关注且亟需解决的重大科学问题。然而,人类衰老的过程漫长且复杂,小鼠等模式动物的衰老过程与人相差甚远,人类衰老的转化医学研究一直面临着巨大的挑战。成年早衰症(Werner Syndrome)是一种罕见的常染色体隐性遗传病,由 WRN 基因(编码一种 DNA 修复/解旋酶)的突变所致。成年早衰症患者自青春期开始提前启动衰老程序,加速呈现出自然衰老的表征并伴发多种老年性疾病。因此,研究成年早衰症对于揭示人类自然衰老的奥秘以及实现防治衰老相关疾病具有重要的科学意义。
研究人员首先提出“组织干细胞的加速衰老(耗竭)可能是成年早衰症的病因”这一科学假设,并通过基因组靶向编辑技术使得人间充质干细胞(MSC)中的 WRN 基因发生纯合缺失突变,在实验室创造出人类早衰症特异的 MSC。这些早衰症 MSC 不仅表现出生长速度减慢、DNA 损伤反应加剧和分泌大量炎性因子等衰老指征,而且表现出内层核膜蛋白以及核周异染色质的加速缺失。通过对组蛋白共价修饰、DNA 甲基化、以及 RNA 转录本进行全基因组扫描,研究人员发现早衰症干细胞的异染色质发生了显著的结构退行性变化,主要表现为着丝粒和端粒附近的 H3K9me3“山脉”(mountains)的缺失。进一步研究发现,WRN 蛋白同异染色质蛋白 SUV39H1 和 HP1?共存于一个蛋白复合物中,该复合物具有维持异染色质和核纤层的稳定性以及阻止 MSC 衰老的作用。WRN 的缺失导致异染色质结合蛋白的减少以及着丝粒卫星 DNA 的转录,进而诱发细胞衰老。通过比较健康老年人和年轻人体内分离的 MSC,也可见 WRN 水平的下调以及核膜蛋白和异染色质结构的异常,提示异染色质的重塑可能是正常细胞衰老的驱动力之一。最后,研究发现过量表达 HP1?能抑制早衰症细胞的加速衰老,因而为未来干预人类干细胞的衰老提供了可能的分子靶标。
人们普遍认为,衰老来源于细胞内不断聚集的 DNA 损伤(基因组不稳定性)。作为支持该理论的重要依据之一:DNA 损伤修复蛋白 WRN 的突变会导致人类成年早衰症。此项研究首次利用人类成年早衰症的干细胞模型,揭示了 WRN 蛋白在维持异染色质稳定性方面的全新功能,阐明了染色质的高级结构失序在细胞衰老中发挥的驱动性作用,并由此提出人类干细胞衰老可能归因于表观遗传改变和基因组不稳定性的互作。
此项工作由中科院生物物理所、北京大学、中科院动物所、解放军 306 医院、深圳大学以及 Salk 研究所等科研机构合作完成。中科院生物物理所刘光慧研究员、北京大学生命科学学院生物动态光学成像中心汤富酬研究员、以及 Salk 研究所 Juan Carlos Izpisua Belmonte 教授为该论文的共同通讯作者。中科院生物物理所助理研究员张维绮、北京大学博士研究生李静宜、Salk 研究所博士后 Keiichiro Suzuki 以及中科院动物所研究员曲静为本文的并列第一作者。此项研究受到国家自然科学基金委、科技部 973 计划、中科院干细胞与再生医学战略先导专项、以及北大-清华生命科学联合中心的资助。